A Agência Nacional de Vigilância Sanitária (Anvisa) decidiu nesta quarta-feira (19) adiar a decisão sobre se libera ou não a venda de testes rápidos de Covid-19 para que a população possa realizar o exame em casa, os chamados autotestes.
Quatro diretores decidiram pelo adiamento para cobrar mais dados do Ministério da Saúde. A liberação dos autotestes foi pedida pela pasta do ministro Marcelo Queiroga diante da explosão do número de casos com a chegada da variante ômicron. Especialistas criticam a visão do ministério e cobram, entre outros pontos, que os testes sejam gratuitos.
Apesar de a relatora do processo, Cristiane Rose Jourdan, votar pela liberação da venda dos autotestes, a maioria dos integrantes da diretoria da Anvisa decidiu acompanhar o posicionamento do diretor Rômison Rodrigues Mota.
Em sua apresentação, Rômison Mota sugeriu a realização de diligências, dentro de um prazo de até 15 dias, para cobrar do ministério a formalização de uma politica publica antes de tomar uma decisão. O presidente da agência e mais dois diretores acompanharam a divergência, fechando o resultado de 4 votos pela busca de mais informações e um voto pela liberação.
Em seus posicionamentos, os diretores criticaram a falta de uma política pública do Ministério da Saúde para testagem ampla da população. Os diretores também apontaram a falta de regulamentação sobre o uso do autoteste, apesar de ela ter sido cobrada durante o processo.
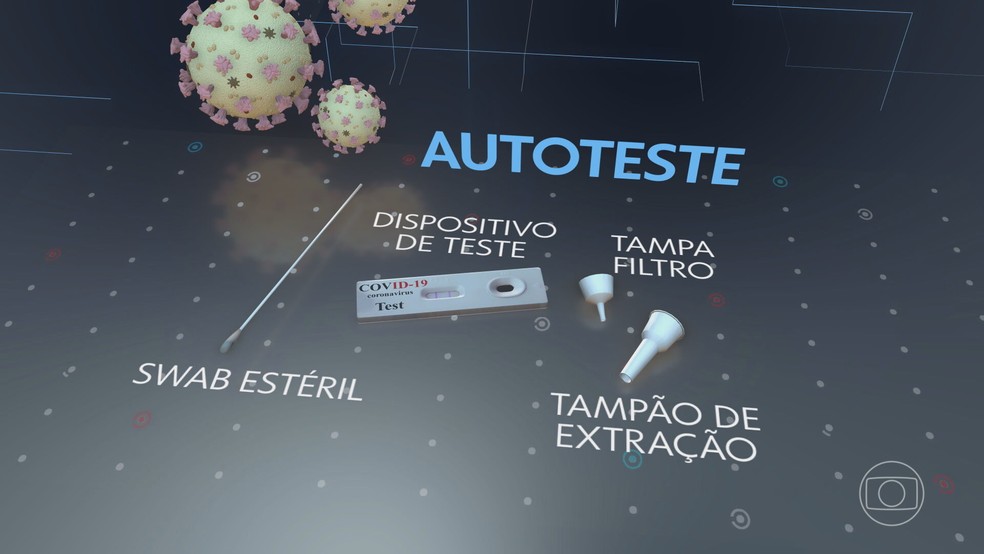
O que é o autoteste?
O autoteste é parecido com o teste rápido, mas pode ser feito por leigos, em casa. O kit vem com um dispositivo de teste, tampão de extração, filtro e o swab – uma espécie de cotonete usado para a coleta nasal, a mais comum.
Um dos principais pontos levantados pela Anvisa é a falta de orientação sobre como se dará a notificação, ou seja, se os casos positivos serão incluídos no balanço oficial. Os testes realizados dentro das farmácias são contabilizados regularmente.
A relatora do processo, Cristiane Rose Jourdan, defendeu a aprovação fazendo a ressalva de que o produto “pode representar excelente estratégia de triagem” e “medida adicional” no controle da pandemia. Entretanto, a relatora defendeu a liberação em “regime excepcionalidade”, pois também apontou a falta de uma política pública e de estratégias para uso dos produtos.